众所周知,开发一种新药从最初的想法到最终产品的推出是一个复杂的过程,可能需要12-15年,成本超过10亿美元。而细胞制剂作为一种活的药物,从研发到上市的过程往往会更加复杂,需要企业投入更多的心血。
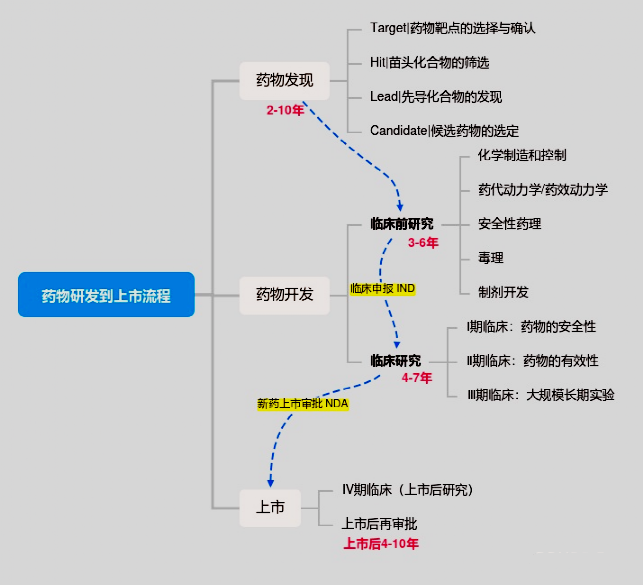
研发一款成熟的干细胞生物制剂,第一步就是培养细胞,因此选择一款性能优良的培养基就成了重中之重。而友康的GMP级间充质干细胞(MSC)无血清培养基正是一款为了干细胞生物制剂研发申报而开发的成分完全明确的限定级培养基。
在前几期文章中,我们从MSC的基础干性、核型检测、免疫抑制与调节能力等方面,阐述了友康的GMP级MSC无血清培养基培养出的细胞在质量方面的有效性和安全性。本期文章我们就从药物申报方向为大家展示,友康如何为用户提供一站式解决方案。
一、干细胞制剂开发要点
干细胞制剂开发过程要服从GMP原则,要了解友康的GMP级产品能在哪些方面为用户提供帮助,我们就先要了解干细胞制剂开发的要点。干细胞制剂药学研究,主要包括工艺开发与质量评价:
1、干细胞库与工作细胞库建立
供者筛查、组织采集,细胞分离、纯化、培养、保藏、鉴别、效力检测,以及生物学特性、遗传学稳定性研究,干细胞库技术标准及工作标准建立。
2、干细胞制剂工艺开发与药学研究
大规模细胞扩增、细胞制备工艺、剂型选择、包装选择、处方筛选、制剂冻存/复苏工艺,体外操作对干细胞生物学特性的影响,过程质量控制,干细胞药物放行标准建立。
3、干细胞制剂冷链运输和稳定性研究
产品冻存与复苏、冷链运输技术、临床快速检验、稳定性研究等,稳定性研究包括冻存条件下制剂影响因素试验、长期试验,模拟临床应用条件的试验等,通过这些实验获得的药品稳定性信息来确定药物的储存运输条件、包装以及有效期。
三、MSC的安全性和有效性
新药的临床前研究环节对于药物的安全性和有效性十分看重,会做许多质量检测来评估MSC是否能通过IND受理申请。
▲MSC的安全性评估
干细胞制剂药理毒理学研究基本内容包括:
1、干细胞药物分布和代谢
同种/异种干细胞在动物体内的分布、定植、分化和转归等。
2、干细胞药物临床前有效性评价
异种/同种干细胞在动物(鼠及大动物等)疾病模型体内有效性评价。
3、干细胞药物临床前安全性评价
一般毒性、特殊毒性(致瘤、促瘤、免疫毒性、生殖毒性等)、长期毒性评价试验。
友康的GMP级MSC无血清培养基培养出的间充质干细胞,通过了细胞鉴别、细胞纯度、染色体核型分析、端粒酶活性和致瘤性等多项验证,质控指标完全符合行业标准。
▲MSC的有效性评估
与MSC质量检验相关的生物学有效性质量属性评价主要包括三类:
1、多向分化潜能
以成骨、成脂、成软骨诱导分化功能为代表。
2、免疫调控功能
以总淋巴细胞增殖抑制、抑制 Th1/Th17 细胞亚群和促进 Treg 细胞亚群、抑制TNF-α炎症因子释放和分泌 IDO等免疫调节分子为代表。
3、组织再生功能
以抗凋亡、促血管形成、分泌各种促进组织再生的活性因子(如HGF和IL-6)、促进M2巨噬细胞极化等功能为代表。
在本系列之前的文章中展示了,友康的GMP级MSC无血清培养基培养出的MSC在细胞的基础干性、三系分化、免疫抑制与调节能力等方面具有良好的性能,细胞的有效性是经得起考验的。
三、友康GMP级产品一站式服务
干细胞技术从实验室到临床,需要经过无数的考验,而GMP级产品是克服重重阻碍的一把利刃。
友康GMP级产品可以在干细胞药物申报过程中为您提供一站式服务,帮您解决细胞培养、细胞消化、细胞冻存等一系列问题。
▲细胞培养
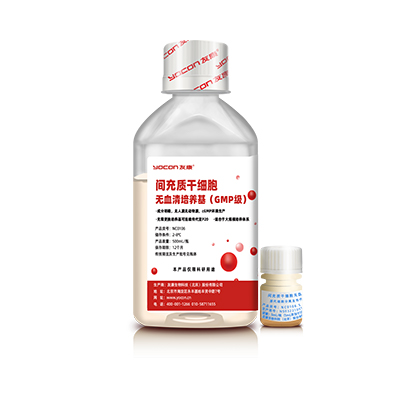
GMP级间充质干细胞无血清培养基
专为间充质干细胞药物申报、临床研究开发的GMP级成分限定的无血清培养基。
√成分明确:蛋白种类不超过20种,总含量低于1.5mg/mL,全部为人工重组体系,无人源无动物源。
√连续传代:无需更换培养基即可实现原代分离及高代次传代。
√工业级培养:改善细胞贴壁性能,适合细胞产品的大规模生产及3D培养体系。
▲细胞消化
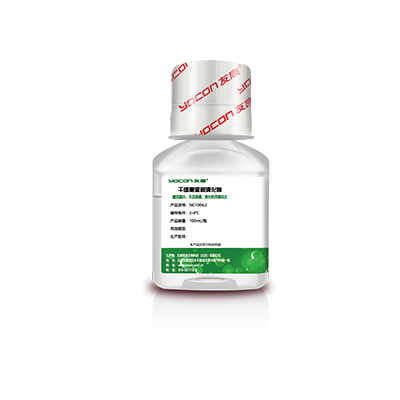
干细胞温和消化酶
专用于间充质干细胞传代消化的无动物源基因重组消化酶,更适用于无血清体系。
√无血清无动物源:无动物源基因重组消化酶,无需担心外源蛋白与病毒残留。
√消化作用温和:正常消化时间为1-2分钟,消化程度易控制,操作容错率高,适合大规模生产。
√对细胞保护性更强:正常消化时,细胞活率相比传统胰酶高出10%,细胞回收率比传统胰酶高出11%-14%。
√极限消化时间长达15分钟:极限消化细胞长达15分钟几乎无影响,传代培养后细胞依然正常生长。
▲细胞冻存
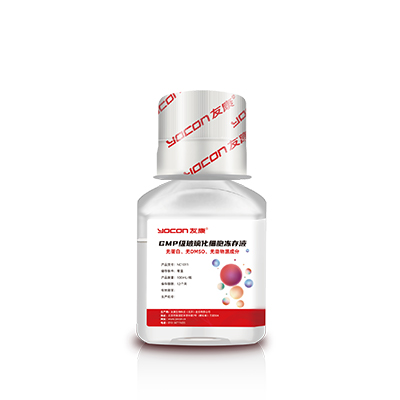
GMP级玻璃化细胞冻存液
无蛋白、无DMSO、无动物源成分,玻璃化冻存实现原位复苏的GMP级玻璃化细胞冻存液。
√成分明确:无蛋白,无血清,无动物源成分,所有成分明确。
√通用性:无DMSO,无细胞毒性物质,安全性高。
√简易性:无需程序降温,可直接投入-80°C,12h(或过夜)后,置于液氮中长期冻存。
√成本低:可以常温运输及保存,运输成本大大降低。
当然,要实现干细胞技术从实验室走向临床,注定要踏过多重困难,经历漫长沉淀,或许细胞药物的上市之路会非常曲折,但在国家政策与市场导向的双重驱动下,在像友康这样不断开拓创新的上游供应商的支持下,相信干细胞造福人类将是既定的结局。

 友康生物
友康生物 2023-05-24
2023-05-24 公司热点
公司热点



